肝炎・肝がん治療
肝炎・肝硬変の主な疾患について
肝臓がんの現状
日本の肝がん死亡者数は、2000年代前半を最多とし、その後はゆっくりと減少しつつあります。しかし、いまだ年間死亡数が3万人を超えており、死亡順位でみると、男性では肺がん、胃がん、大腸がんに次いで第4位、女性では大腸がん、肺がん、胃がん、膵臓がん、乳がんに次いで第6位となっている、対策が極めて重要な疾患です。
肝臓がんは早期発見が難しく、予後の悪いがんといわれてきましたが、近年では少しずつ変わりつつあります。肝炎対策基本法が施行されて以降、肝炎患者を診療する体制は有機的に整備され、肝炎ウイルスの治療は飛躍的に進歩しました。
肝炎・肝硬変とは
肝炎とは
肝炎とは、肝炎ウイルスに感染後、肝臓に血液中の細胞である「リンパ球」が集まる炎症が起こり、これが原因で肝細胞が長期にわたって破壊され続ける病気です。
その症状としては、全身倦怠(けんたい)感、食欲不振、尿の濃染(尿の色が紅茶のように濃くなる)、さらには黄疸などがあります。しかし、自覚的には何の兆候もなく、自然に治癒することもあります。また、肝炎ウイルスが身体に侵入しても、「肝炎」という病気にならず、健康な人体と共存共栄し、「ヒトは何らの身体的被害を受けず、肝炎ウイルスもヒトの身体から駆逐されず体内にとどまる」という状況もあります。
このように、体内に肝炎ウイルスを持っていても健康な人のことを肝炎の「キャリア」といいます。肝炎ウイルスの感染経路としては次のようなものがあります。
- 妊娠・分娩による感染
- 血液製剤の注射による感染
- 性行為による感染
- 針刺し行為による感染
以上、肝炎ウイルスの感染ルートについて、現在わかっているものについて解説しました。しかし、1)~4)の感染ルートのどれにも思いあたるものがないという場合も多く、「このルートだ」と断定することは必ずしも容易ではありません。したがって、肝炎ウイルスの感染は個人の意識・知識によりある程度予防できますが、防止できない部分があることも事実です。肝炎ウイルスに感染してしまったら、即、肝がんになり、生命が脅かされるわけではありませんが、「肝がんの高危険群」と考えて対処すべきです。
肝硬変とは
肝硬変とは、上記に記載した肝炎が慢性肝炎へと進行後、肝細胞が破壊された跡に線維が沈着し、肝臓が硬くなる病気です。肝臓が破壊されて、それが再生しようとするときに線維化が起こることを「肝線維化」と呼びます。この肝線維化が進むと肝硬変になります。
肝硬変が進行すると、浮腫、腹水、黄疸などの症状がみられるようになり、食道胃静脈瘤などの消化管の病変を併発すると、吐血などを生じる場合もあります。
肝硬変のうち、正常な部分によって肝臓の働きがある程度保たれている状態を「代償性肝硬変」と呼び、さらに病気が進み、必要な肝臓の働きが失われた状態を「非代償性肝硬変」と呼びます。
そして、破壊された肝臓がもとの状態に戻ろうとするときに正常に戻れない細胞が肝臓がんです。肝臓がんの80パーセントは肝硬変を合併していますので、肝硬変が長期化すれば高い確率で肝臓がんになります。
肝炎・肝硬変になる原因
肝炎の大部分は、肝炎ウイルスによる感染が原因です。肝炎ウイルスが肝細胞に感染すると、これを対外に除外する「免疫」という反応により炎症が起こり、肝臓に集まったリンパ球がウイルスに感染している肝細胞を攻撃します。
日本では肝炎の原因として、約70%がC型肝炎ウイルス、15~20%がB型肝炎ウイルスの感染によるといわれています。また、ウイルス感染ではなく、誤って自分の肝細胞を攻撃する「自己免疫性肝炎」というものが原因となる場合もあります。しかし、肝炎と肝硬変の原因は、ウイルス感染や自己免疫性肝炎によるものだけではありません。アルコールの飲みすぎや肥満、糖尿病などによって、肝細胞に脂肪が溜まる場合も肝臓に炎症が起こります。これを「脂肪性肝炎」と呼び、慢性肝炎と同じように肝線維化が進むと肝硬変、肝がんを併発する場合もあります。
肝炎・肝硬変の治療法
肝炎や肝硬変がウイルスによるものであれば、肝炎ウイルスに対する薬物療法が最も重要です。抗ウイルス薬によって肝炎ウイルスを排除したり、ウイルスの増加を抑えると肝臓の炎症は治まります。その結果、肝線維化の進行が止まり、肝がんが発生するリスクも低下します。また、時間はかかりますが、肝臓に溜まった線維が溶けて硬くなった肝臓が元に戻ることもあります。抗ウイルス薬が効かない場合や使用できない場合には、肝細胞が破壊されるのを抑える薬を内服、または注射で投与する肝庇護療法を行います。体内の鉄の量を減らす瀉血療法も肝細胞が破壊されるのを抑えるのに有効です。
自己免疫性肝炎では、免疫の力を抑えるために副腎皮質ステロイドを投与します。また、脂肪性肝炎では、禁酒や食事療法と運動療法による体重制限が最も重要な治療法です。これらの治療で改善しない場合は、薬物療法を行う場合もあります。
当院では肝がんのプロフェッショナルとして、患者さまに合わせた治療法を様々な方法で行っております。肝臓に関する疑問や不安など、気軽にご相談ください。
消化器内科(肝臓疾患)の詳しいご案内
CART療法
腹水濾過濃縮再静注法(CART:Cell-free and Concentrated Ascites Reinfusion Therapy)とは
腹水について
大量の腹水が貯留すると腸管・静脈などが圧迫されて様々な症状(腹部膨満感・食欲低下・下肢のむくみなど)が生じます。
腹水に対して水分や塩分制限、利尿剤の投与などを行いますが、それでも貯留するものを難治性腹水と呼びます。
難治性腹水に対しては、腹水を抜いて捨てる方法や、CART(カート:腹水を採取してろ過濃縮し、蛋白成分などを点滴で体に戻す方法)といった方法があります。
KM-CART
当院では、KM-CART法を中心としてCARTを行っています。
従来のCARTでは、腹水処理中の濾過膜閉塞の為、3~4L前後しか処理できませんでした。
松崎圭祐先生(現:要町病院 腹水治療センター長)が開発されたKM-CART法は膜洗浄が可能なシステムです。
この方法を用いる事により、詰まりやすい性状の腹水であっても高速で大量の処理が可能です。
また、大量の腹水を処理する為、多くの蛋白を静注点滴する事が可能であり、1回あたりの効果が高くなります。
実績
当院では2010年よりCARTを開始、2017年よりKM-CART法を導入し、腹水の全量採取・処理を行っています。
●2017年~2021年のKM-CART症例数は約640例です。
●1件あたりの最大処理腹水量は約18リットルです。
●1件あたりの平均処理腹水量は約7リットルです。
スケジュール
▶基本的に2泊3日で行います。
▶1日目は術前検査 2日目にCART 3日目は採血の結果を確認して退院、という流れです。
▶CARTは保険適応の治療法です。(2週間に1回まで)
▶まずはかかりつけ医にご相談下さい。診療情報提供書と共に当院外来を受診して頂きます。(受診予約が必要です)
お問い合わせ:代表TEL:0942-35-1000
肝臓がんの知識
疫学
- 死亡者数(2006年)33,662人/罹患数(2002年)40,604人
- 発症の危険因子(リスクファクター)国内の「肝臓病」の多くを占めるのはウイルス性肝炎(B型またはC型)であり、その中でもC型肝硬変合併肝細胞がんが最も代表的です。
- 肝細胞がん症例におけるHBs抗原・HCV抗体陽性率:HBs抗原15.5%、HCV抗体69.6%、両者ともに陽性4.0%
診断
肝臓病の診断には、血液検査、画像診断、場合により組織診断が必要となります。

※第47回日本肝がん研究会 日本化薬株式会社共催 ランチョンセミナーにて使用
血液検査
一般的な肝機能の血液検査
ウイルス関係の血液検査
画像診断
肝細胞がんのスクリーニング、確定診断、治療方針の選択においては、画像診断が非常に重要になります。
1.超音波
簡便で非侵襲的、スクリーニング検査として有用されています。
造影剤の登場で、肝腫瘍の質的診断や肝細胞がん治療後の遺残・再発に対する有用性が向上しました。
2.CT
dynamic studyが必須。典型的な肝細胞がんは、造影早期相で濃染し、後期相で周囲の肝実質と比べ低吸収となる。
3.血管造影・angio-CT
ヘリカルCTの登場によりDSA(digital subtraction angiography)を含めた血管造影の意義は低下しており、診断としての血管造影は推奨されません。また、血管造影をしながらCT撮影するangio-CTは小病変の検出に有用ですが、常に行う検査ではありません。
4.MRI
CT造影剤に対するアレルギーを有する症例などでガドリニウム造影剤を使用したdynamic MRIが施工されます。また、新規のMRI用造影剤であるガドキセト酸ナトリウム(Gd-EOB-DTPA)は、ガドリニウムイオンと脂溶性側鎖をもつEOB-DPTAのキレート化合物で、投与後早期には従来の正常肝細胞に取り込まれ、肝特異性造影剤として作用します。そのため、1回の投与で肝腫瘍の血流評価と肝細胞機能の評価が可能となります。
画像診断によってわかること
- AFP(エー・エフ・ピー)
肝がんの存在の目安となります。(高いから必ずがんがあるのではない) - L3分画
AFPの3つに分けたもので、L1、L2、L3がありL3の占める%が高くなると、肝がんの悪性度が上がります。(一般に30%以上は注意が必要です) - PIVKA-Ⅱ
これも肝がんの目安になります。
2008年4月より、肝がんの経過観察をされている患者さまは、両方(AFP、PIVKA-Ⅱ)を測っても保険適応となっています。(それまでは一つのみ適応でした)
検体検査
肝細胞がんに対するAFPの感度・特異度は、カットオフ値により大きく異なります。AFP-L3分画はカットオフ値10ng/mlで感度22~33%、特異度93~94%、PIVKA-Ⅱカットオフ値40mAU/mlで感度28%、特異度95~96%と、AFPに比し特異度が高いです。これらを組み合わせることで、感度が向上します。肝内胆管がんでは、早期発見に有用とされるマーカーはありませんが、CA19-9、CEAなどが経過観察や治療効果判定などに補助的に使用されます。
腫瘍生検
動脈相での腫瘍濃染を示す典型的な肝細胞がんについては、病歴、画像所見および腫瘍マーカーを組み合わせることで確定診断が可能であること、また生検は播種や出血のリスクを伴うことより、組織診断は必須ではありません。乏血性の腫瘍など非典型的な場合には、経皮的肝生検による組織診を考慮します。
放射線診断
1.CT
一度に何枚もの画像を得られるCT(マルチスライス)にて診断を行います。
当院では8枚の画像を一度に得られるCTを使っています。
造影剤を使用し4回以上の撮影を行うことにより、より詳しい肝がん、血管の状態等の診断が可能となっています。
2.angio-CT
通常のCTでは見えないような肝がんを見えるようにすることができます。
ただし、この検査は血管造影の検査を行わないとできませんので、安易に行うような検査ではありません。
(肝がんの存在を強く疑う場合に行うべき検査)
3.エコー
エコーの進歩は著しく、肝がんの診断には2007年1月に発売となった、ソナゾイドという造影剤を使って造影エコーを行うのが標準と言っても過言ではありません。また、造影エコーは、治療の効果判定にも使用できます。当院ではアロカ社製のα‐10を使用しております。
4.炭酸ガスエコー
腹部エコーに使う造影剤の登場で、以前より行う頻度は減りましたが、できものを確実にエコーで見えるようにするには有用な手段です。ただし、これも血管造影をしなければ可能ではないという問題はあります。
肝臓の悪性腫瘍は、以下の2つに分類されます。
- 原発性肝がん:その大部分がB型肝炎やC型肝炎などの慢性肝障害を背景として発症する肝細胞がんや胆汁の通路を形成する細胞から発生する胆管細胞がん。
- 転移性肝がん:大腸がんや胃がんなどの肝臓とは別の臓器に発生したがんが血流やリンパ流を介して肝臓に転移したがん。
当院ではこれらの肝がんが初期の状態から進行した状態まで、その病態に応じた治療を行っております。
当院ではこれらの肝がんがまだ直径10mmにも満たない初期の状態から肝臓の半分以上を占拠するような進行した状態まで、その病態に応じた治療を行っております。どのような状態のがんであっても最善の道はあるはずです。患者さまのがんの状態を、腹部超音波検査・CTスキャン・血管造影などの各種画像検査によって十分把握し、その方の肝機能や腎機能などの身体状況や年齢・性別などを加味して、最も有益かつ延命に有用な治療を前向きに行うべく努力しております。
どのような状態のがんであっても最善の道はあるはずです。
患者さまの肝がんの状態に応じた最善の治療を行うためには、幅広い治療オプションが必要となります。当院では、経皮的エタノール注入療法(PEIT)、経皮的ラジオ波焼灼療法(RFA)、経カテーテル性肝動脈化学塞栓術(TACE)、肝動脈リザーバーを用いた動注化学療法、静脈リザーバー(CVポート)を用いた全身化学療法などを行っており、それぞれを最高水準の技術力によって患者さまに提供しております。また、私(板野)が2000年に考案した特殊リザーバーシステム-iは、皮下埋め込み式リザーバーでありながら体内留置したカテーテル内にもう一本のマイクロカテーテルを経皮的挿入可能な新しい治療システムです。この特殊システムを用いることで肝がんばかりでなく、体内に生じたあらゆる場所のがんに対して選択的動注化学療法・塞栓療法が可能となりました。現在は切除不能膵がんや大腸がんの原発巣に対しても経動脈性の抗がん剤注入治療を試みており、良好な結果が得られております。さらに上述したがんに対する直接治療を円滑に行うための補助療法にも新しい方法を導入しております。血小板を上昇させ出血傾向を改善させるための部分的脾動脈塞栓術、がん治療を行う上で妨げとなる難治性腹水を改善させるデンバーPVSなどを必要に応じて併用しており、患者さまのさらなる予後改善に寄与しております。肝臓に腫瘍ができたと指摘されお悩みの方、他施設ではすでに治療法がない進行がんであると診断され治療法を探されている方、当院がご相談に応じたいと思います。
肝臓がんの治療
肝切除、経皮的治療[ラジオ波熱凝固療法(RFA)]、エタノール注入療法(PEIT)、肝動脈(化学)塞栓療法(TAE・TA(C)E)、肝動注化学療法(TAI)、全身化学療法、放射線療法、肝移植などがあります。治療法の選択に際しては、腫瘍側因子と肝予備能の両者を考慮し決定します。肝細胞がんは再発することが多く(多中心性発生や肝内転移)、腫瘍の局在や大きさ、数、背景肝の状況など、多くの要素が治療の効果、予後に影響を及ぼしますので、これらの治療法を組み合わせて治療を行います。
肝切除
確実な局所コントロールが期待できますが、侵襲が大きいため、肝予備能の不良な場合は適用されません。
ラジオ波熱凝固療法(RFA)
高周波電流による誘電加熱を利用して腫瘍を凝固壊死させます。複数の比較試験の結果、3年生存率がPEITに比べ有意に高いことが示されてます。原則、最大径3㎝以下、病変数3個以下が適応です。手術に比べ低侵襲が長所ですが、腫瘍径、腫瘍数により適応に限界がある事、腫瘍近傍の血流により治療効果が不十分になる事があるなど短所もあります。
経皮的エタノール注入療法(PEIT)
超音波ガイド下に細径針を用いて腫瘍内にエタノールを注入します。1病変に対して3~6回の治療が必要です。適応はRFAと同じで、低侵襲です。肝予備能による適応の制約が少なく繰り返し治療が可能ですが、腫瘍数、腫瘍径により限界があり、局所再発をきたす可能性があります。
肝動脈(化学)塞栓療法(TAE・TA(C)E)
確実な局所コントロールが期待できますが、侵襲が大きいため、肝予備能の不良な場合は適用されません。
- TAE…transcatheter arterial embolization。
患部に塞栓物質だけを投与する治療法。 - TA(C)E…transcatheter arterial chemoembolization。
患部に塞栓物質と抗がん剤を混ぜたものを投与する治療法。
複数の比較試験の結果、無治療に比べ生存期間の延長が得られることが示されました(Hepatology 2003;37:429-442)。腫瘍の栄養血管にカテーテルを挿入し、化学療法剤とリピオドールの懸濁液および塞栓物質(ジェルパートなど)を注入します。化学療法剤はアンスラサイクリン系薬剤、プラチナ系薬剤を用います。
肝動注化学療法(TAI)
肝予備能が悪くTACE不能例、高度の門脈腫瘍栓を伴う例などに行います。肝動脈造影後間欠的(システムi)に、または留置された動注リザーバーカテーテルを通じて薬剤(プラチナ系、5FU系)を投与します。
全身化学療法
遠隔転移を有する例や、手術、局所治療、TACEの適応のない進行例に対して施行されます。
肝移植
Milan基準を満たす症例が適応となります。脳死肝移植はドナー不足の問題があり、親族をドナーとして行われることが多いです。
Milan基準:
- 腫瘍は単発で5㎝以下 もしくは、3㎝、3個以下
- 血管浸潤を伴わない
- 遠隔転移を伴わない
放射線療法
近年、陽子線や重粒子線治療が注目されていますが、まだ標準治療として確立するにいたっていません。
現在、リザーバー肝動注で治療効果が得られにくい巨大肝がんはシステムiで治療していますので、今後はさらなる生存率の改善が予想されます。
以上の治療で、ある程度のサイズの肝がんであれば制御できますが、肝炎の畑に育ってしまう芽を肝がんとするならば、肝炎自体の治療ができなければ、肝がんの進行を抑えることはできません。
当院ではここ数年、原発性肝がん以外の消化器がんも治療を行っております。特に、大腸がん肝転移に代表される転移性肝がん、胆管胆嚢がんや膵がんの切除不能例に対しては、当院独自の血管造影技術を用いた治療を行っており、治療成績は向上しています。
消化器内科(肝臓疾患)の詳しいご案内
肝臓がんの治療法
現在、肝臓がんにおいては様々な治療法があります。肝臓がんのプロフェッショナルである当院では、腫瘍の局在や大きさ、数、背景肝の状況など、多くの要素が治療の効果や予後に影響を及ぼすため、以下のような方法を組み合わせて治療を行っています。
肝臓がんの治療法
肝切除
がんとその周囲の肝臓の組織を手術によって取り除く治療法
経皮的治療【ラジオ波熱凝固療法(RFA)】
高周波電流による誘電加熱を利用して腫瘍を凝固壊死させる治療法
エタノール注入療法(PEIT)
超音波ガイド下に細径針を用いて腫瘍内にエタノールを注入し、アルコールの化学作用によってがんを死滅させる治療法
肝動脈塞栓療法(TAE)、肝動脈化学塞栓療法(TACE)
TAE:患部に塞栓物質だけを投与する治療法。
TA(C)E:患部に塞栓物質と抗がん剤を混ぜたものを投与する治療法。
肝動注化学療法(TAI)
血管造影に用いた肝動脈造影後間欠的(システムi)に、または留置された動注リザーバーカテーテルを通じて薬剤(プラチナ系、5FU系)を投与する治療法。
全身化学療法
遠隔転移を有する例や、手術、局所治療、TACEの適応のない進行例に対して、局所的な治療で効果が期待できない場合などに行われる治療法。
放射線療法
骨に転移したときなどの疼痛(とうつう)緩和や、脳への転移に対する治療、血管(門脈、静脈)に広がったがんに対する治療などを目的に行われます。近年、陽子線や重粒子線治療が注目されていますが、まだ標準治療として確立するにいたっていません。
肝移植
肝臓をすべて摘出して、ドナー(臓器提供者)からの肝臓を移植する治療法。ある一定の基準を満たす症例が適応となります。
現在当院では、リザーバー肝動注で治療効果が得られにくい巨大肝がんはシステムiで治療していますので、今後はさらなる生存率の改善が予想されます。
肝動注化学療法について
肝動注化学療法(TAI)とは、皮下に埋め込んだリザーバーと肝動脈に入れたカテーテルを通して肝動脈に直接抗がん薬を流し込み、できるだけ効率的に治療を行う方法です。肝予備能が悪くTACE不能例、高度の門脈腫瘍栓を伴う例などに行います。
当院では、肝動脈造影後間欠的(システムi)に、または留置された動注リザーバーカテーテルを通じて薬剤(プラチナ系、5FU系)を直接投与しています。がんが体の一部分に発生している場合、がんは動脈から栄養されているので、静脈から全身に抗がん剤を投与するのに比べ、何倍もの濃い抗がん剤が作用することになります。また、肝動脈に直接抗がん剤を流し込むことで、全身に流れる抗がん剤の量が少なくなるため、副作用も少なくなることが期待できます。
抗がん薬治療のポイントは“いかに治療効果を高め、副作用を抑えるか”にあります。肝臓は血管の集合体のような臓器で、そこにできたがんは血流が豊富です。そこで、がんにつながる肝動脈を狙って抗がん薬を入れることで、豊富な血流に乗って抗がん薬が流れ込み、効率的な治療を行うことができます。ちなみに、肝臓に入った抗がん薬はその後全身に回りますが、全身化学療法に比べ他の臓器に及ぼす影響が少なく、副作用をある程度抑えることも可能といわれています。
このように、肝臓の動脈(肝動脈)に直接抗がん剤を投与する治療法が「動注化学療法」と呼ばれるものです。
治療の特徴
- カテーテルで肝動脈に抗がん薬を直接注入する
- 抗がん薬の副作用は全身化学療法より抑えられる
- 進行がんや門脈腫瘍(しゅよう)栓のあるがんにも有効
- 術後生存率は肝切除とほぼ同等
肝臓がん治療 動注リザーバーによる肝動注化学療法
動注リザーバーとは
通常行われている抗がん剤治療は、内服(飲み薬)あるいは注射(静脈注射・点滴)によって薬を投与します。これは抗がん剤治療として一般的に知られている治療方法ですが、全身に抗がん剤が投与されることになり、副作用を引き起こす可能性も高くなります。一方、このページで紹介してある「動注リザーバー療法」という治療方法は、カテーテル(細い管)をがんの近くにある血管まで挿入し、「リザーバー」という小さな器具と接続することで、がんに直接抗がん剤を投与することができます。皮膚の上から針を刺すだけで、がんの近くから薬を投与するので、全身に抗がん剤を投与することと比べて、何倍もの濃い抗がん剤が作用することになります。また、全身に流れる抗がん剤の量が少なくなるので、副作用も少なくてすむことが期待できます。
動注リザーバーのポイント
- 代表的なものとして、肝臓がんに対する治療として用いられています
- 入院せずに、外来通院で行うことが可能です
- リザーバーを埋め込んだあとも日常生活を送る上での支障は特にありません
- 副作用としては、リザーバーの埋め込みは小さな手術のようなものなので、出血や感染といった合併症を引き起こす可能性が考えられます(ただし、頻度はまれであり、症状も軽度であることがほとんどです)
- 細い管を皮下に埋め込み薬を投与するので、大きな傷になりません
動注リザーバー留置法
選択的にカテーテル先端を腫瘍部位へ近づけ、ピンポイントに抗がん剤を投与できる治療法です。抗がん剤による肝臓への負担を軽減できます。
皮下に埋め込まれた注入アダプターよりマイクロカテーテルを挿入し、治療が必要な動脈にその都度選択的に挿入して治療を行います。
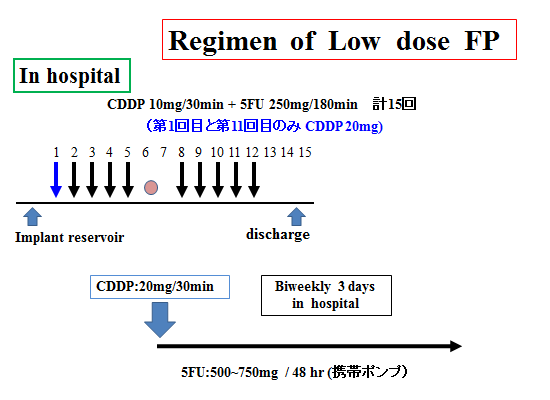
Low dose FP療法(肝動注化学療法)
Low dose FP療法(肝動注化学療法)とは、入院中に15回CDDP(シスプラチン)と5FU抗がん剤を動注する治療法です。入院治療終了後は反応が良ければ外来で動注療法を継続いたします。シスプラチンと5FUはBiochemical modulationとして相性が良い薬剤です。
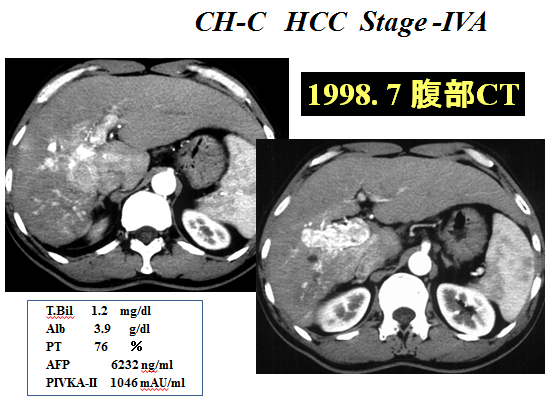
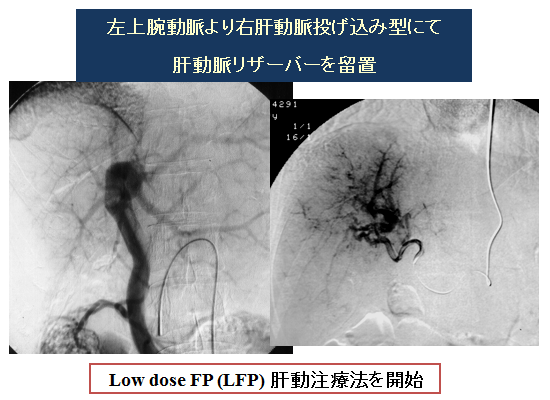
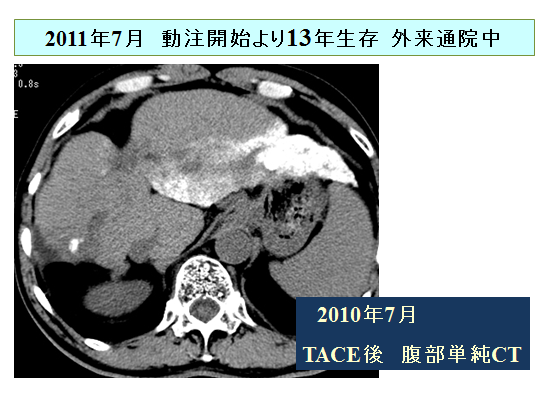
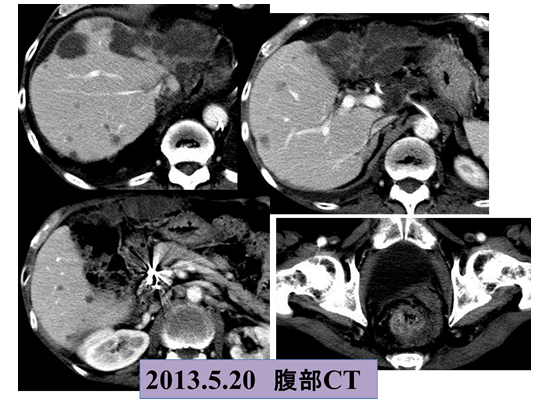
Low dose FP療法の著効例をご紹介します。進行肝細胞がんStageⅣA(AFP:6232ng/ml、PIVKA-Ⅱ:1046mAU/ml)、1998年7月来院時は下記CT画像の状態でしたので、左上腕動脈より右肝動脈投げ込み型にて肝動脈リザーバーを留置し、Low dose FP療法を開始しました。
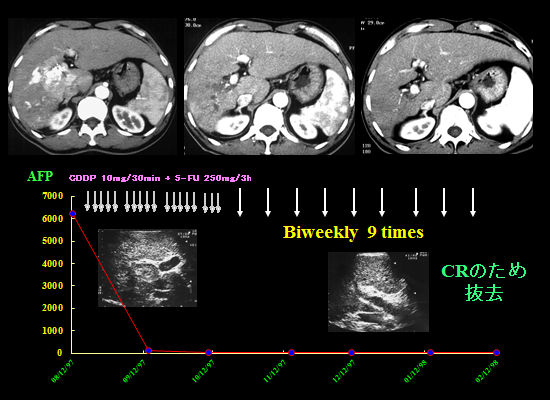
治療開始後1か月で腫瘍マーカーがほぼゼロまで下がりました(CR)ので外来にて動注療法を継続後、リザーバーを抜去できた症例です。Low dose FP療法が著効した症例で、10年以上たった現在も外来にて通院中です。
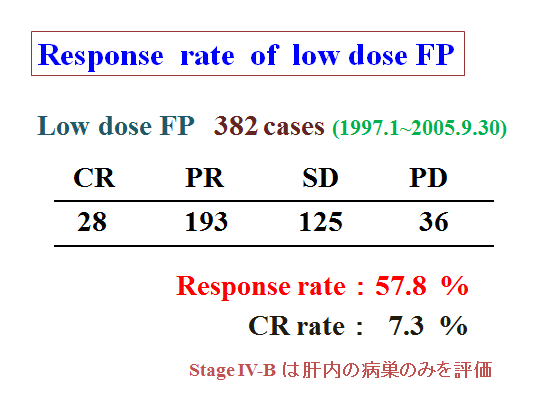
382例のLow dose FP療法の治療効果です。
Low dose FP療法の有効性が消失したと判断した時点で、
1)CRならリザーバー抜去
2)PRで残存が局所療法可能なら局所療法+リザーバー抜去
3)PDかNCもしくは、PRで残存が多い場合は、second line治療へと移ります。

※上記は平成23年7月29日第47回日本肝癌研究会ランチョンセミナーで使用した内容です
StageⅣ治療成績
1997年1月から2005年9月までの期間に動注リザーバー療法を行った肝細胞癌382例のうち、StageⅣ(StageⅣbは肝内の病巣のみ評価)の171例の生存曲線を示します。【図1】
StageⅣが2割強を占めていたにも関わらず、奏効率は2011年6月現在までで47.4%、CR率8.2%で、12.3ヵ月の生存期間中央値(MST)が得られています。このうちChild-Pugh Aの76例でMSTは17.5ヵ月であり【図2】、同じChild-Pugh Aを対象に行われたソラフェニブのSHARP srudy(ソラフェニブのランダム化比較試験)のMST10.7ヵ月と比較しても、動注リザーバー療法は遜色ないMSTが得られています。さらにStageⅣb(12例)のMSTは11.3ヵ月でした。【図3】
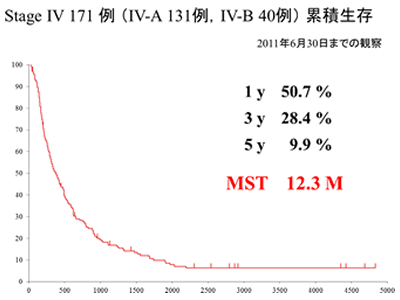
【図1】
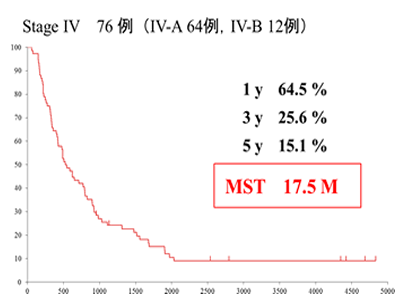
【図2】
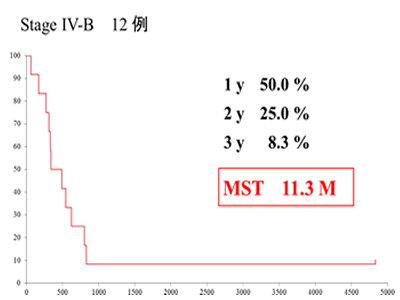
【図3】
382例中、20世紀(1999年12月31日以前まで)に動注リザーバー療法を導入したのは137例で、MSTは27.5ヵ月でした。このうち2011年6月までに5例の生存が認められているため10年生存率は3.64%と算出されます。生存中の5例にはStageⅢ~Ⅳa、Ⅳbや腫瘍占拠率30%以上の進行がんも含まれており、かなり進行したがんでも著効を示し、3~4%の割合で長期生存が得られるということが考えられます。
特殊リザーバー システム-i
これまで多くの症例に動注リザーバー療法を施行し、ある程度の治療成績は得ているものの、例えば最大腫瘍径が80mmを超えるような巨大肝癌は可能であれば腫瘍減量術を先行すべきと考えますが、中には外科的アプローチが困難な場合もあります。
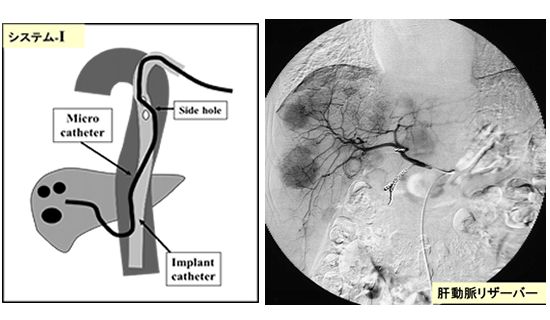
そこで、当院では2000年に「システム-i」というオリジナルのリザーバーを考案いたしました。システム-iは皮下埋め込み式リザーバーですが通常のリザーバーとは異なり、留置されているカテーテルの中にもう一本マイクロカテーテルを挿入できることが特徴です。逆流防止弁付注入アダプターを導入しており、システム-i-1とシステム-i-2の2タイプがあります。【図1】
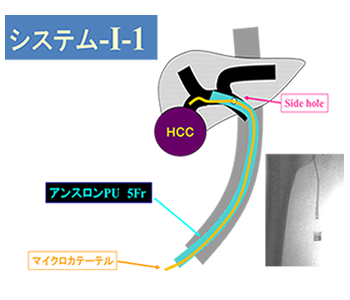
【図1】
システム-i-1は右もしくは左の大腿から肝臓内にカテーテルを留置してside hole(サイドホール)を開け、マイクロカテーテルをside holeから留置カテーテルの外に出し、選択的に目標部位に薬剤を投与します。ピンポイントの薬剤投与が可能なため、著しく肝機能が低下する巨大肝癌でも治療可能となりました。
システム-i-1をバージョンアップさせたのがシステム-i-2です。【図2】システム-i-1はカテーテルを肝臓内に留置するため、リプレイスの肝動脈には使用できない場合がありました。
システム-i-2では左の上腕からカテーテルを挿入して大動脈内に留置させ、胸部付近で留置カテーテルにside holeを開けてマイクロカテーテルを出し、ガイドワイヤーを使ってリシェイプしながらマイクロカテーテルを肝動脈の中に導きます。これにより腹部大動脈から枝分かれしているあらゆる動脈の深部までマイクロカテーテルを挿入することができるようになりました。
リザーバーを駆使した治療により、動注リザーバーが無効であった症例でCR(完全寛解)を得たり、30㎝以上もある巨大肝癌で縮小傾向を認めた症例を経験しています。
その後2004年にはシスプラチン動注製剤アイエーコール®が発売され、治療成績が向上しました。当院では腫瘍占拠率の高い塊状型肝癌などの症例には、手術に先行してアイエーコール®とシステム-iを組み合わせた治療を行っており、その有用性に手応えを得ています。
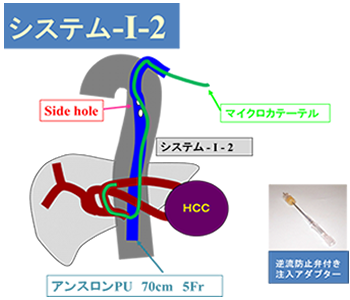
【図2】
システム-Iによりピンポイントで腫瘍部位に薬剤投与が可能となりました
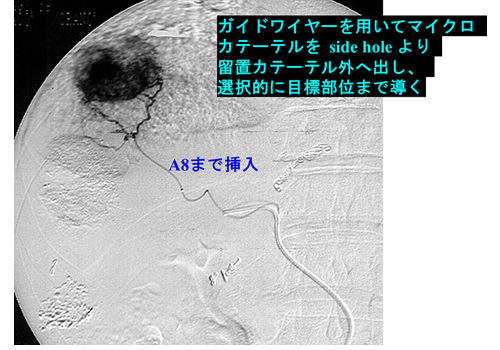
システム-iの最大の利点は、治療が必要な動脈への選択的な治療(TAEや動注療法)を外来通院で何回でも行えることです。このシステムにより通常のリザーバーでは困難であった治療も可能になりました。
システム-I を使用した巨大肝がんの治療 その1
7X歳・女性 肝右葉の肝がん 最大腫瘍径 120mm
脂肪肝を背景とした肝がん Child-Pugh score : 5点
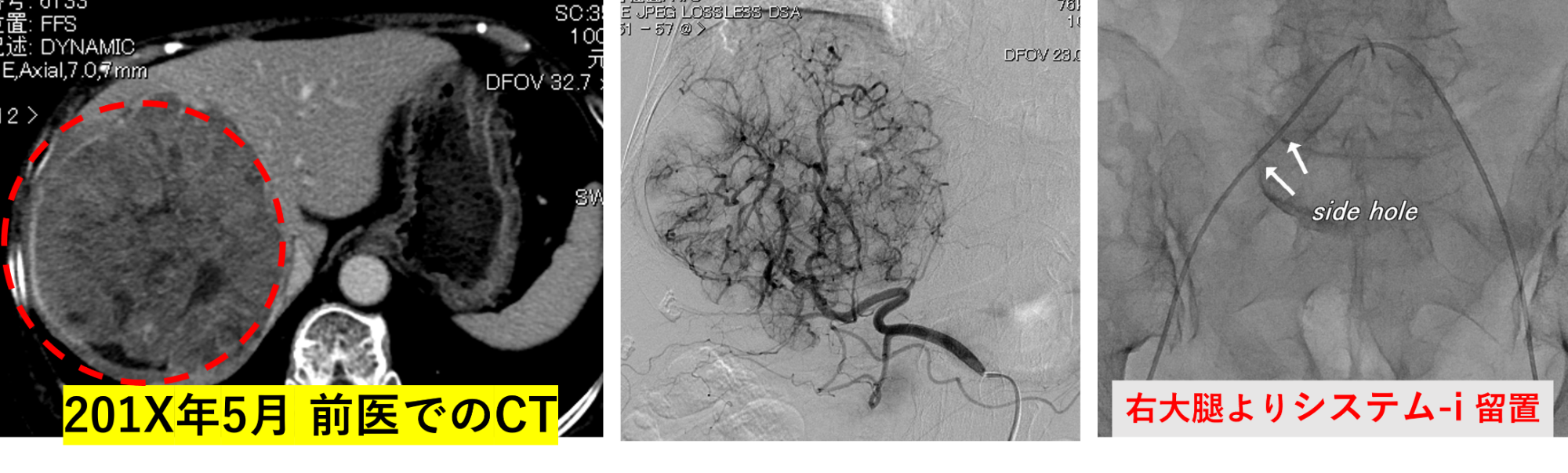
肝右葉の肝がんで、最大腫瘍径は120ミリにも達しています。
脂肪肝を背景としたチャイルドビュースコアは5点です。
右大腿より、システム-iを経由したマイクロカテーテルをその都度、がんの動脈へ挿入して反復したIVR治療を行います。
システム-i を用いた第1回目治療 New FP療法
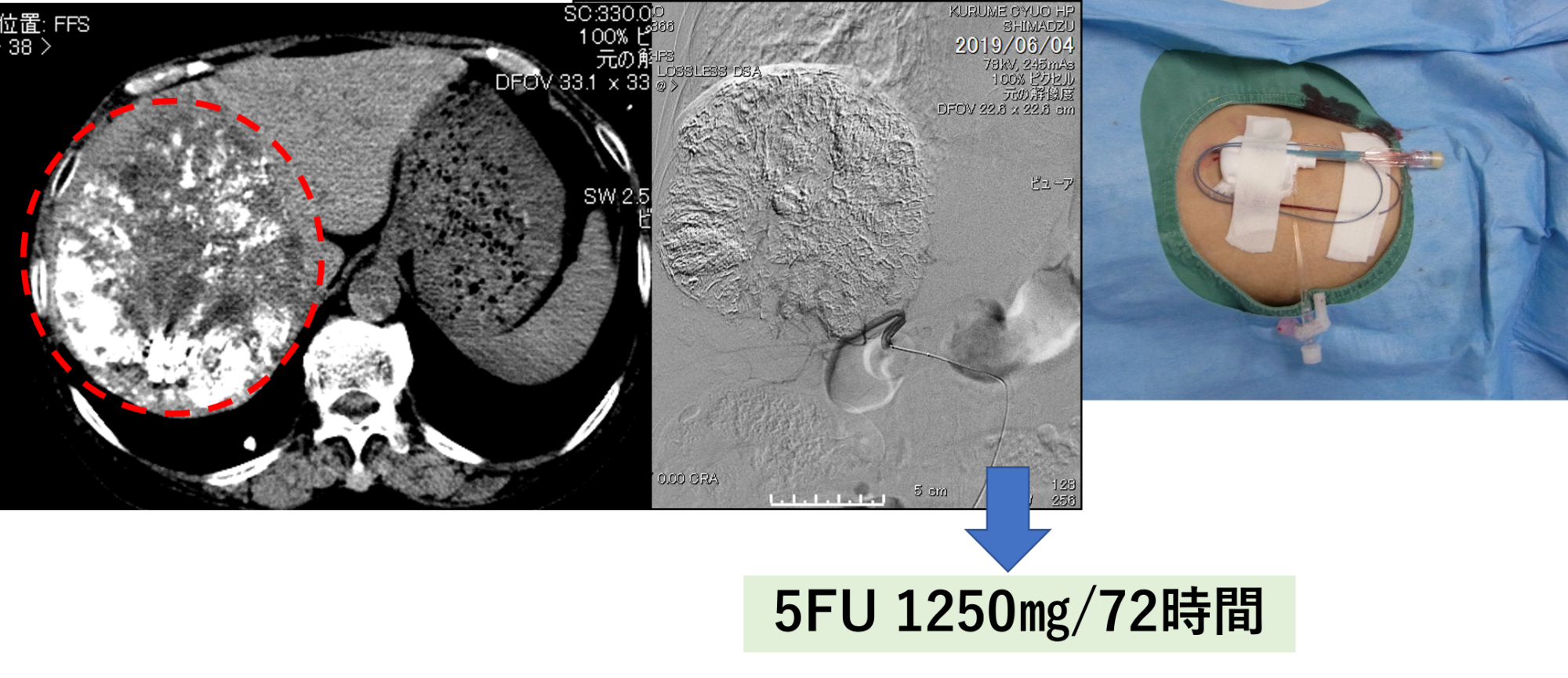
システム-i を用いた第1回の治療状況です。
「New FP療法」は順天堂大学の永松準教授が確立した肝細胞がんに対する治療法です。
70%以上の高い成功率を誇り当院でも巨大肝がんの治療法として用いています。
第7回目治療 右下横隔動脈へのTACE
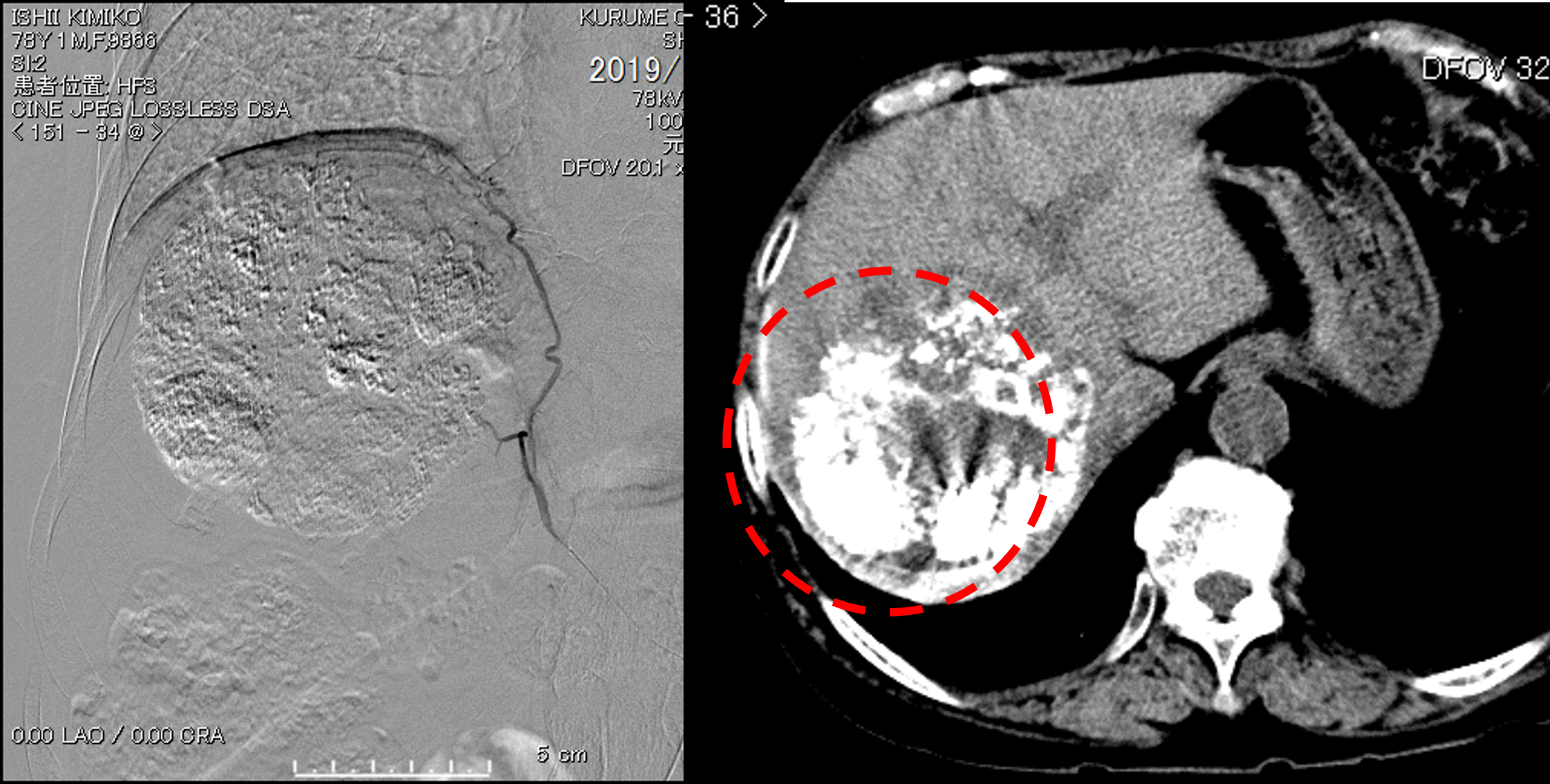
7回目の治療後の状況です。
右下横隔動脈のカテーテルによる化学塞栓療法(以下、TACE)を行いました。
肝癌は、進行すると肝動脈の血流が豊富になるため、TACEが有効な治療法となります。
当院ではシステム-i を用いますので、技術力の高い治療法であるTACEを簡便に行うことができます。
第12回目治療(最終治療) シスプラチン+5FUの持続肝動注
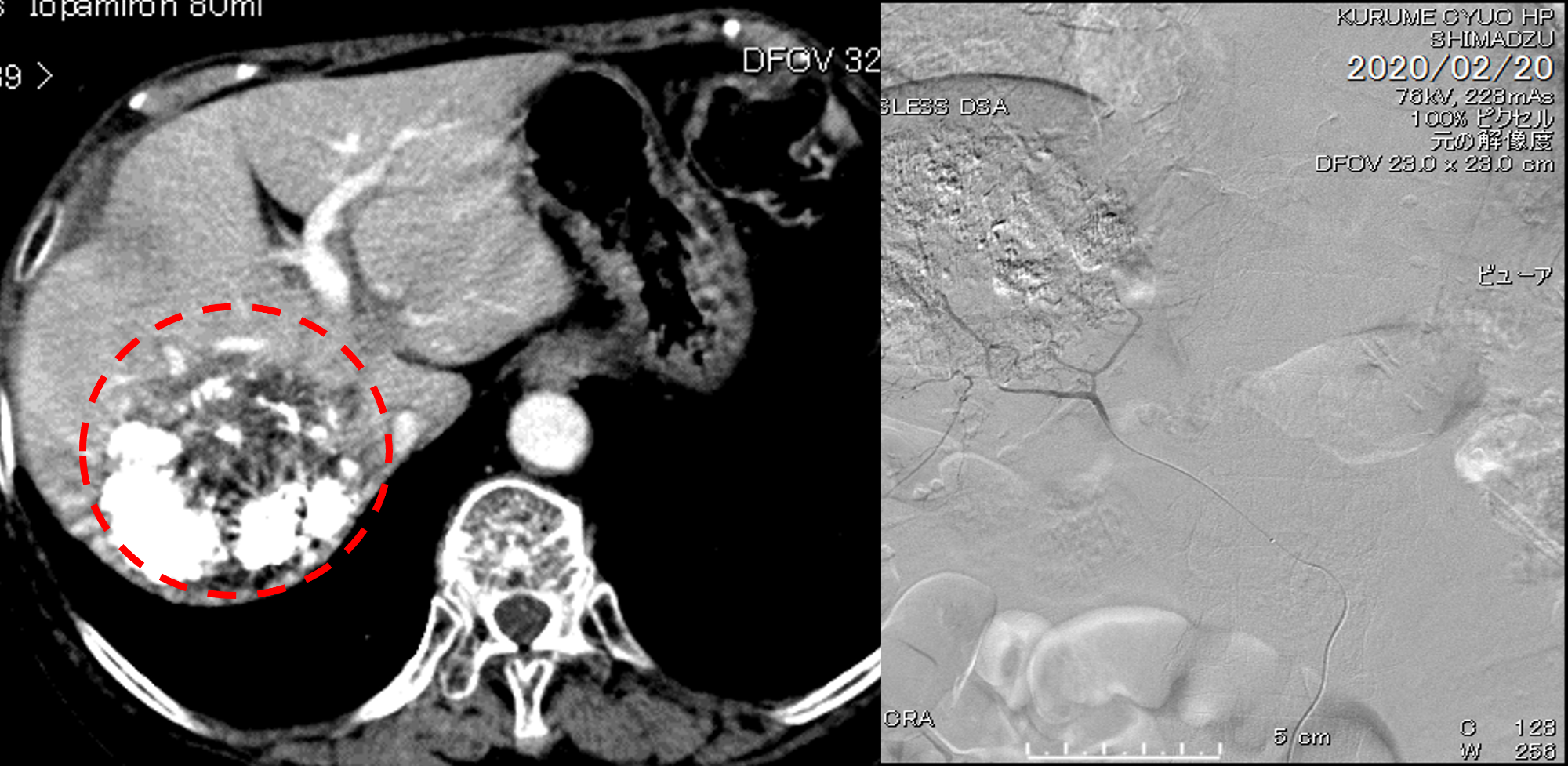
12回目の治療で最終となります。
シスプラチン+5FUの持続肝動注を行いました。
第7回時より明らかにがん細胞は縮小しております。
12回の治療をもって巨大肝がんは完全治癒となりました。
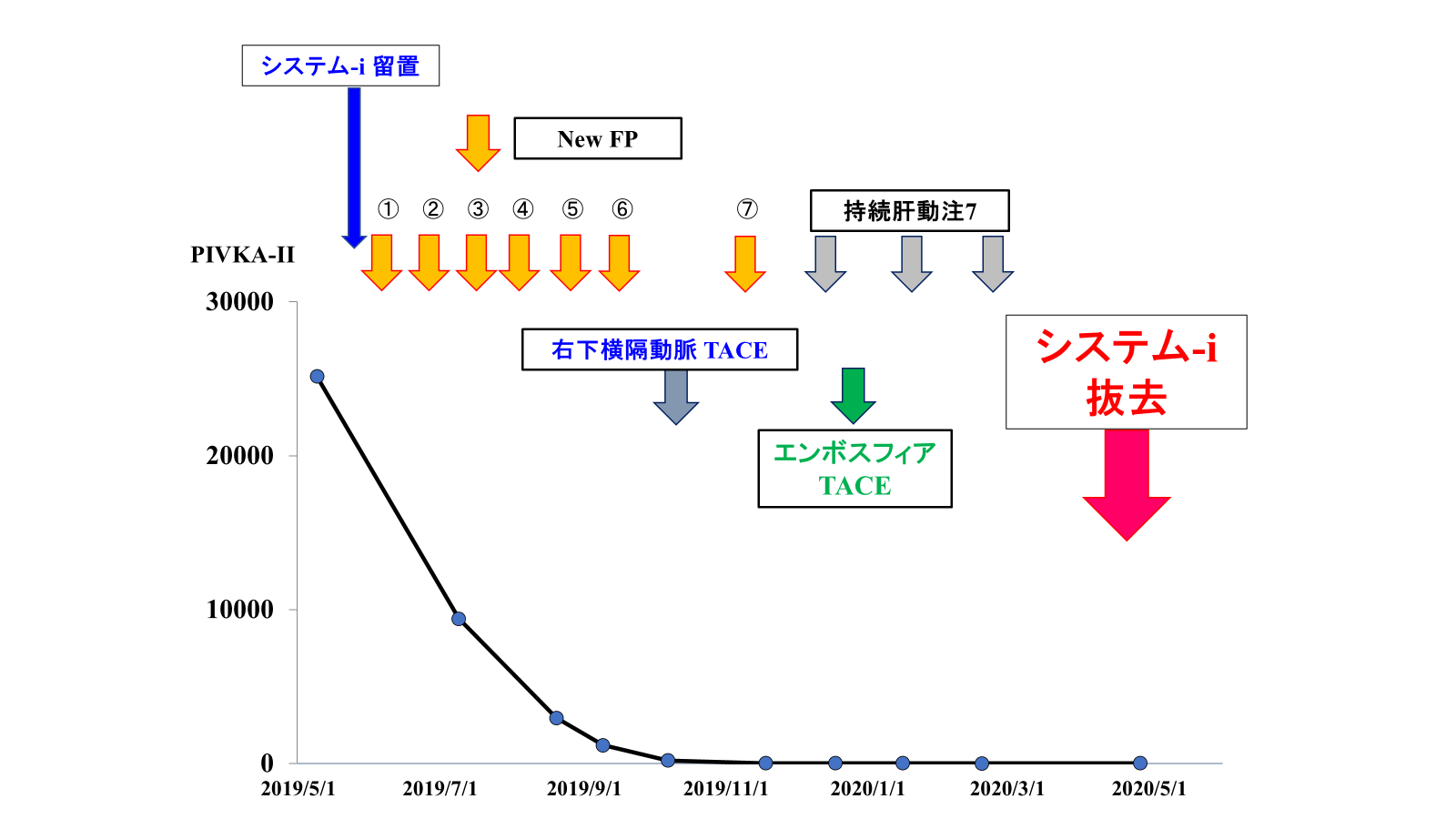
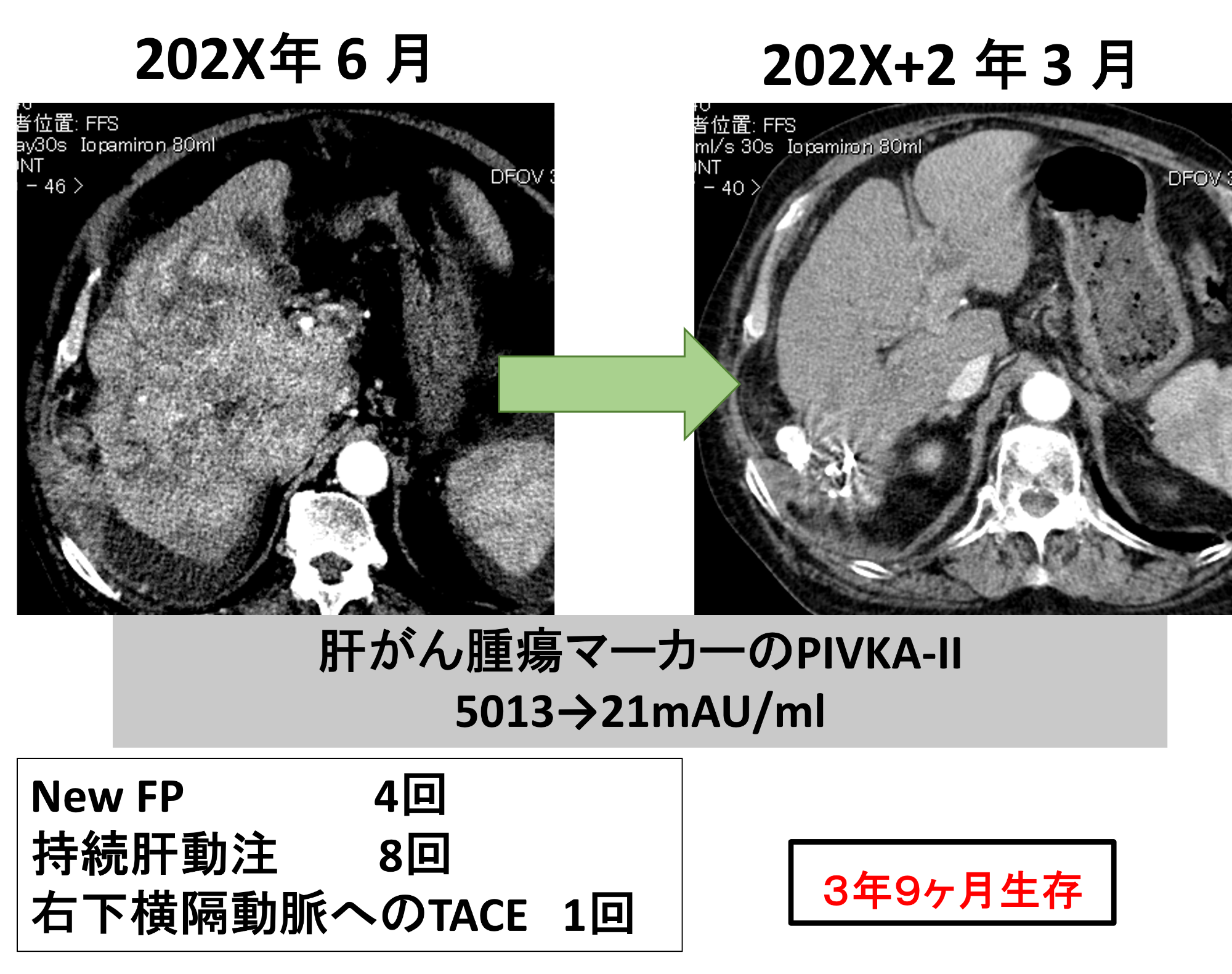
PIVKA II血液検査は、肝臓がんや肝硬変などの肝疾患の診断や経過観察に使用される重要な検査であり、「New FP療法」によって徐々に正常値となっています。
202X年4月 システム-i 抜去時のCT
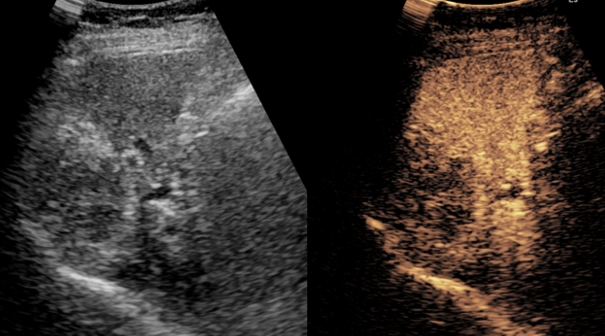
造影エコー検査で治癒の状態と判断
治療開始より5年以上経過
2024年現在、地元でフォローを受けながら無再発で生存中で、治療開始から5年以上が経過しています。
造影エコー検査で治癒状態と判断でき、システム-i を使用した「New FP治療」の効果が証明されました。
今後も患者様が望む限り、私たちもがん治療をあきらめません。
システム-I を使用した巨大肝がんの治療 その2
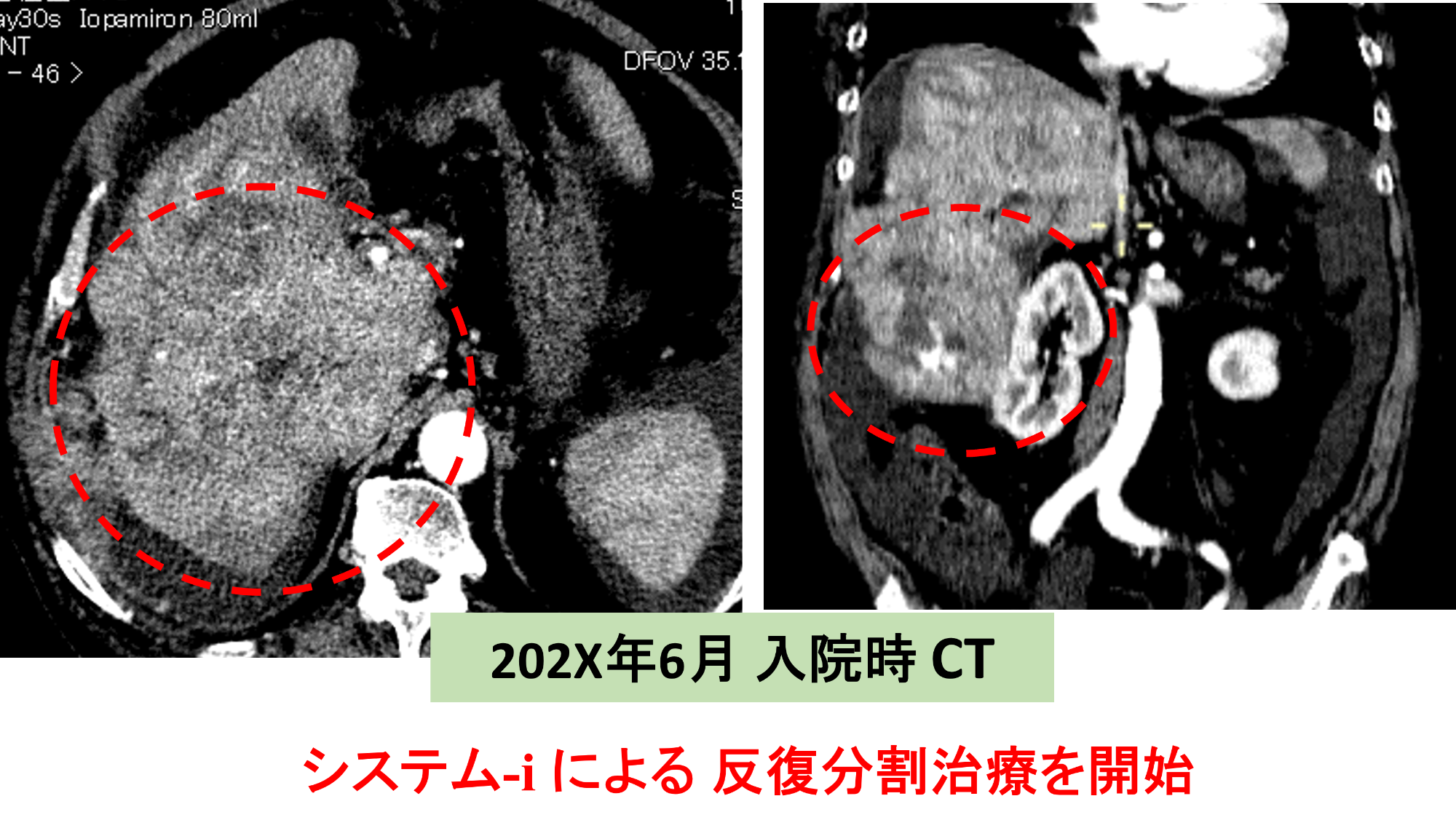
7X歳・男性 肝右葉巨大HCC 最大腫瘍径 160㎜
糖尿病背景の肝がん発症 Child-Pugh score : 9点
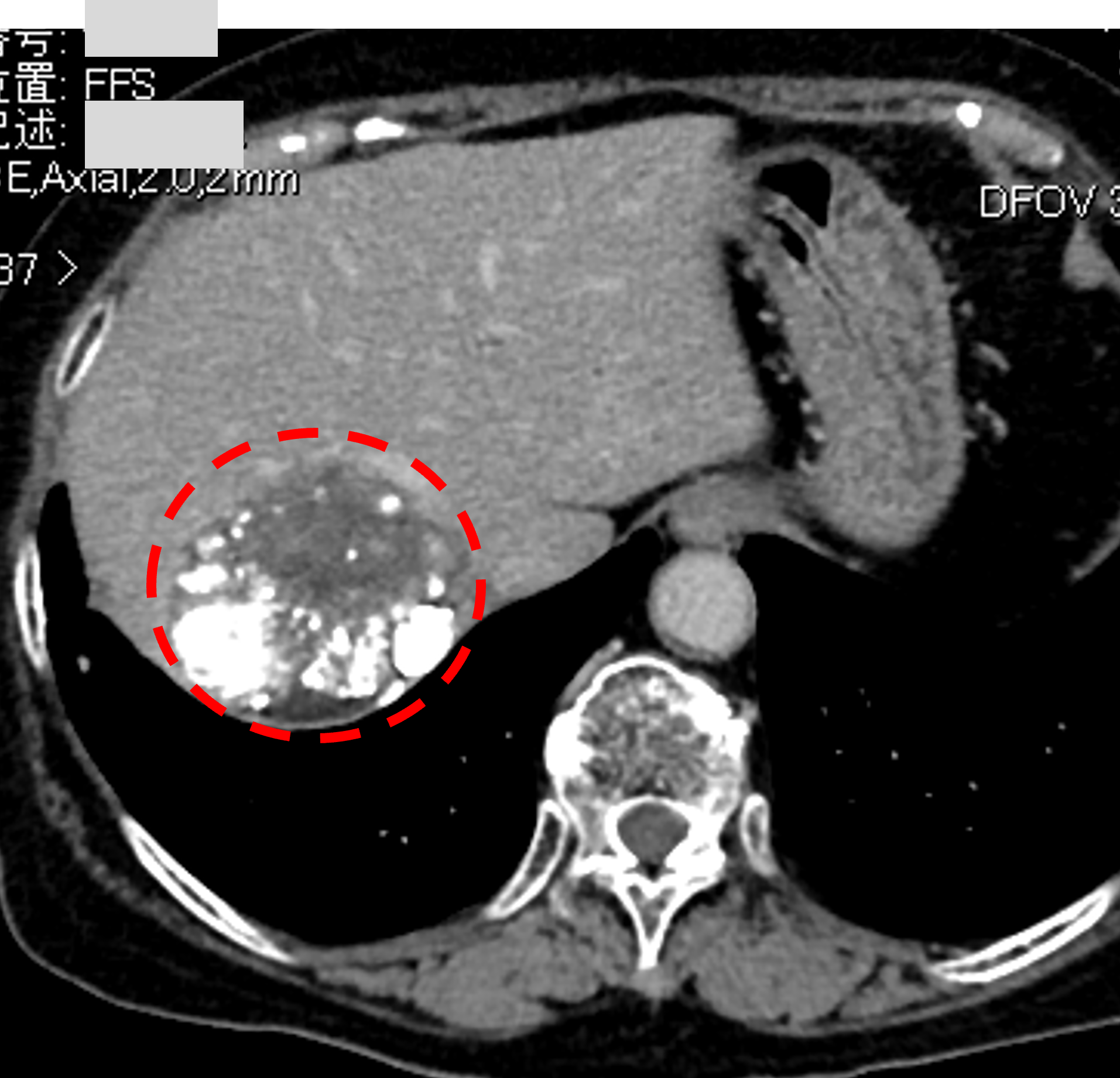
肝右葉の肝がんで、最大腫瘍径は160ミリにも達しています。
糖尿病を背景としたチャイルドビュースコアは9点です。
第1回目治療 分割持続動注
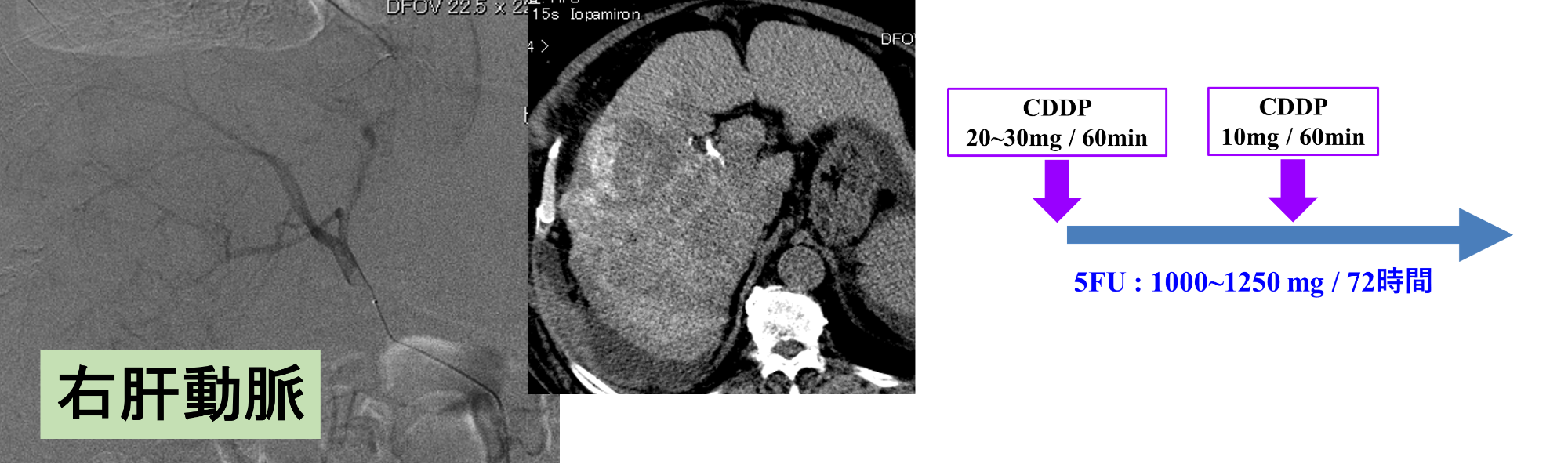
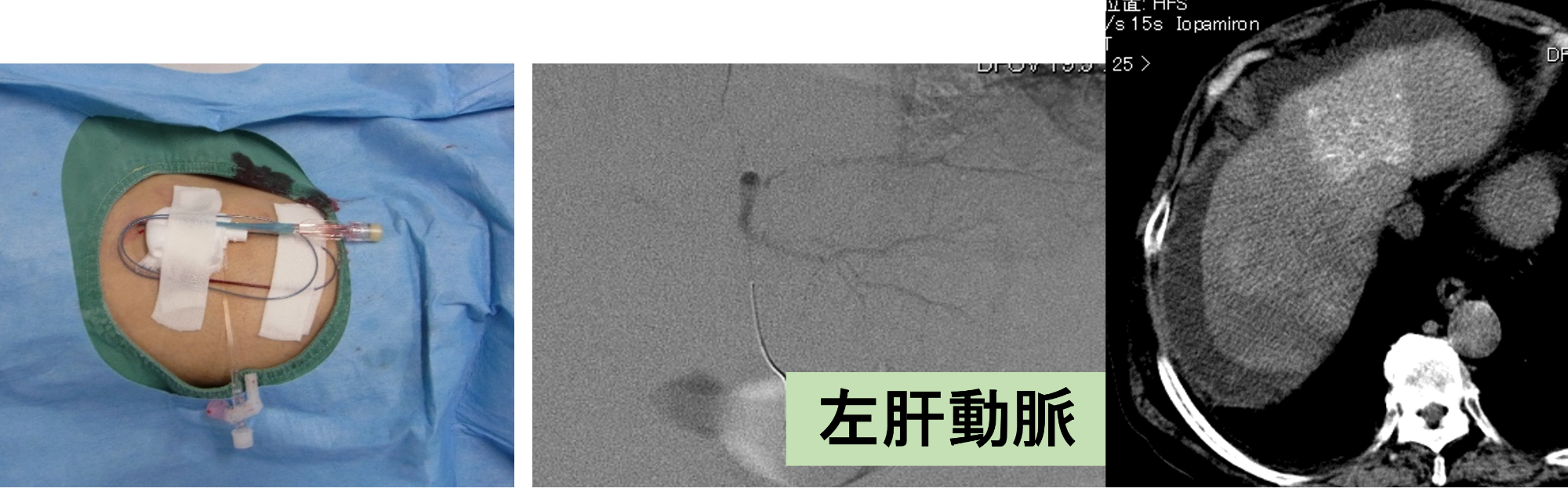
システム-i を用いた第1回の治療状況です。
「New FP療法」は久留米大学が確立した肝細胞がんに対する治療法ですが、70%以上の高い成功率を誇るにもかかわらず、手技がやや煩雑で熟練を要するため、広く普及するには至っていません。
そこで、本治療法を全国的に普及させることを目的として、「New FP研究会」を2018年より実施しております。
第2回目治療 右下横隔動脈へのTACE
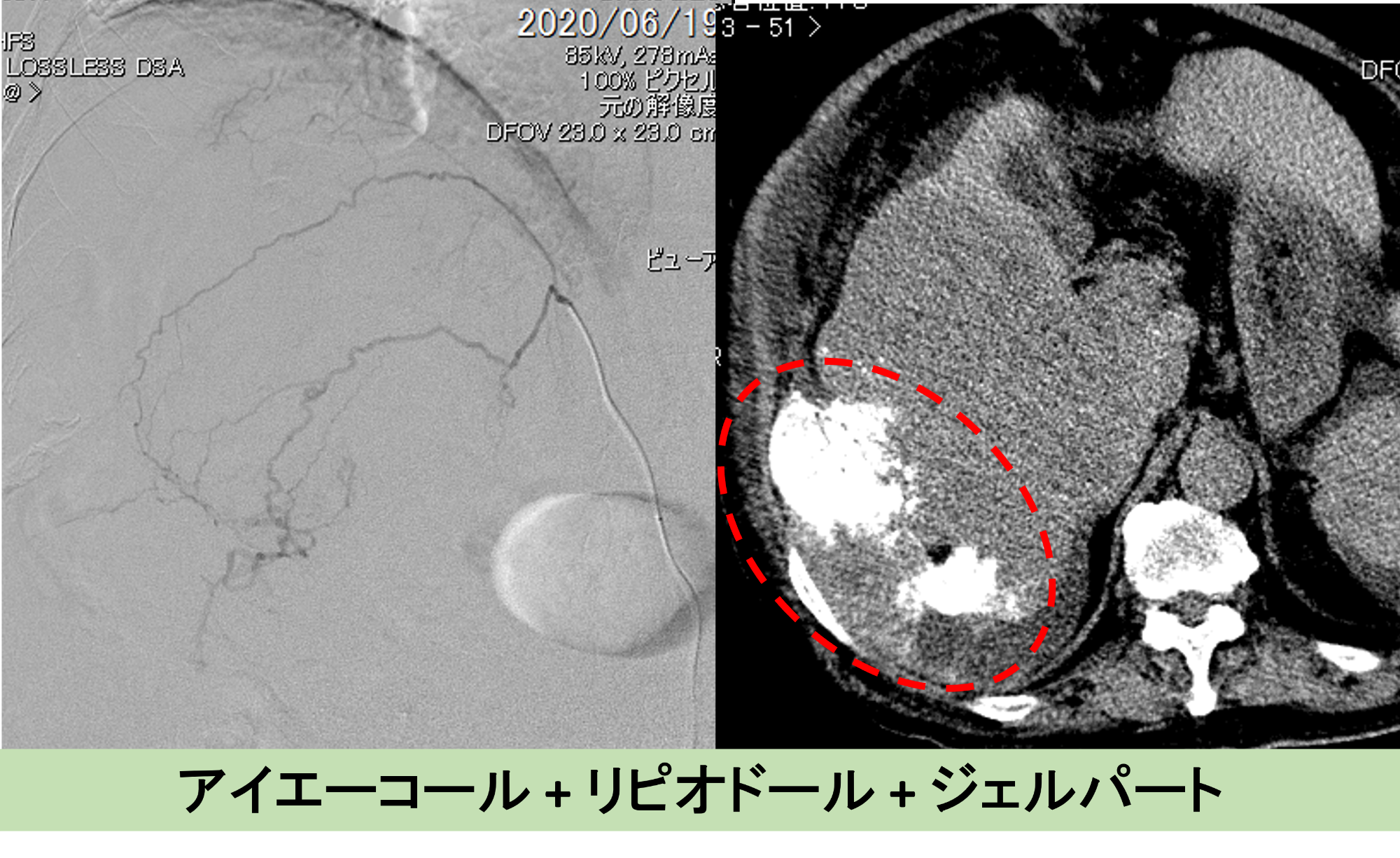
2回目の治療後の状況です。
右下、横隔動脈のカテーテル動脈化学塞栓療法(以下、TACE)。
第5回目治療 右肝動脈へのNew FP
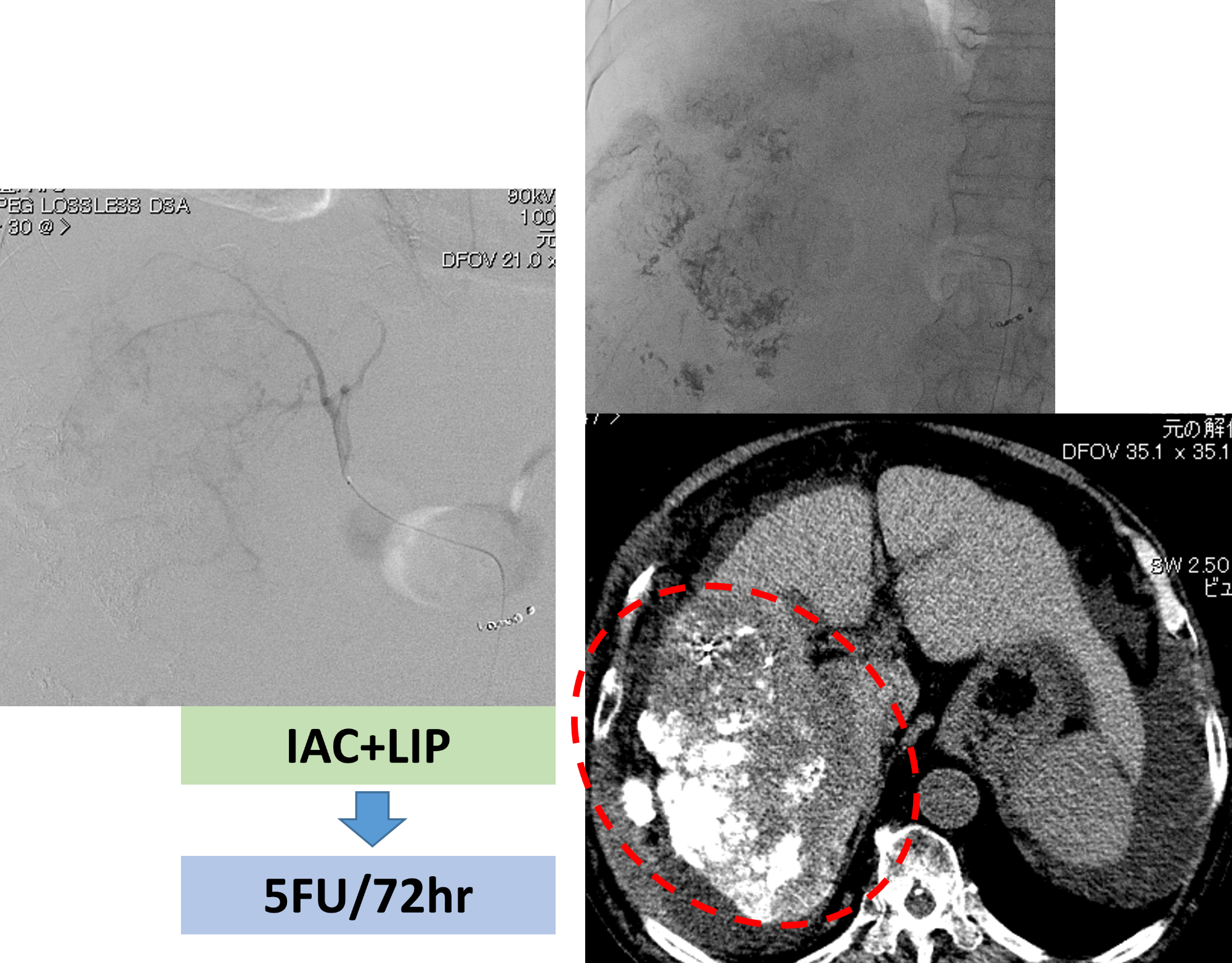
システム-i を用いた第5回の治療状況です。
消化器内科(肝臓疾患)の詳しいご案内
転移性肝がんの治療
転移性肝がんとは、肝以外の臓器にできたがんの細胞が血液の流れに乗って肝臓に移動したものです。転移性肝がんの原発巣は、大腸がん、胃がん、膵がん、乳がんが代表的ですが、肝臓はその血流の豊富さから最も多臓器の転移が生じやすい臓器であり、全身のどの部位のがんでも転移性肝がんを発症する危険は存在します。現在、転移性肝がんの標準治療は全身性化学療法ですが、当院ではリザーバー肝動注化学療法を行い良好な成績を上げています。
大腸がん肝転移治療
system-iによる大腸がん肝転移治療
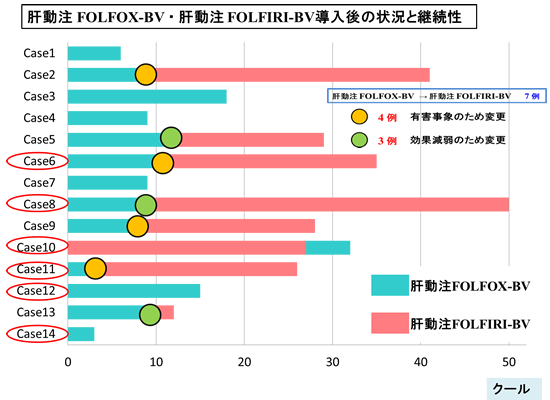
切除不能大腸癌肝転移に対するfirst line therapyは全身化学療法です。しかし予後規定因子となる可能性が高い肝転移巣に対する肝動注化学療法の局所制御性も捨てがたいものがあります。当院では、進行性大腸癌治療に最も汎用されているFOLFOX-Bevacizumab(BV)療法もしくは FOLFIRI-BV療法と使用薬剤や投与時間をほぼ同等にし、oxaliplatin(L-OHP)もしくはirinotecan(CPT-11)と5FUのみ肝動注するレジメンを考案し、主として全身化学療法のfailure(無効例)に対し用いてきました。
System-I
2008年6月以降、当院で肝動注FOLFOX-BV療法もしくは肝動注FOLFIRI-BV療法を施行し、2011年3月まで全経過を観察し得た結腸・直腸癌肝転移14例の経過を解析しました。
14例の背景因子
平均年齢:65.0±8.0歳、男性:女性=8:6例、PS 0:1=12:2例
結腸癌:直腸癌=7:7例 全例 原発巣切除あり
同時性:異時性肝転移=8:6例、慢性肝障害 なし:あり=13:1例(C型肝炎 1例)
肝動注併用FOLFOX-BV療法開始時の肝以外の転移 無:有=9:5例(肺:骨:リンパ節=5:1:2例)治療前CEA:994.9±2776.7ng/ml 前治療あり 13例(前治療が一時期有効であったが徐々に再燃してきた 7例、前治療に有効性が認められなかった 4例、有害事象のため前治療継続不能 2例)

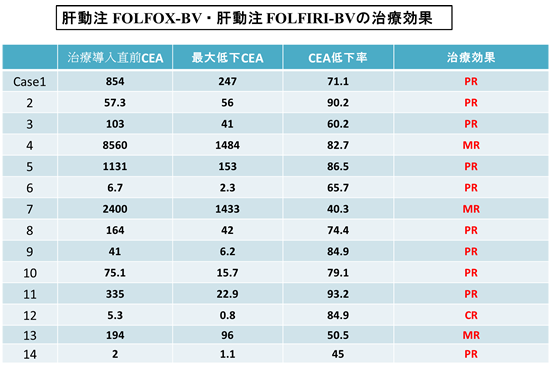
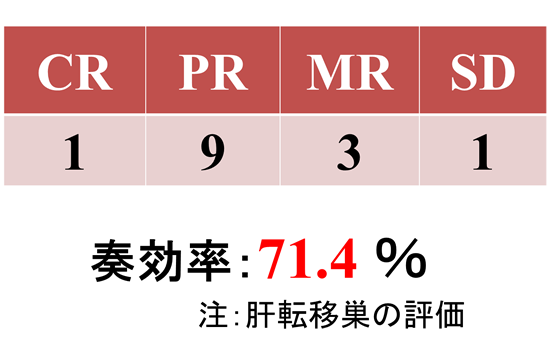
治療前CEA:30ng/ml以上の11例 CEA低下率:73.9±17.0%
CR:1例、PR:9例、MR:3例、SD:1例
奏効率71.4%
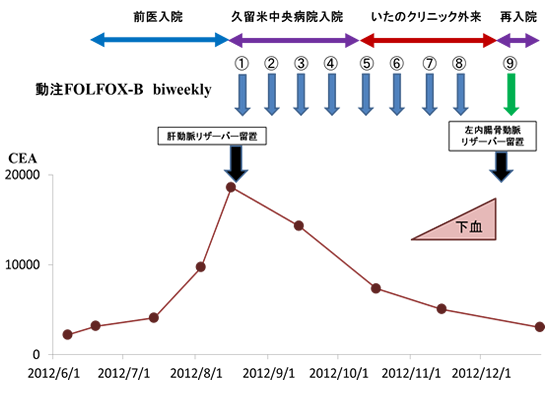
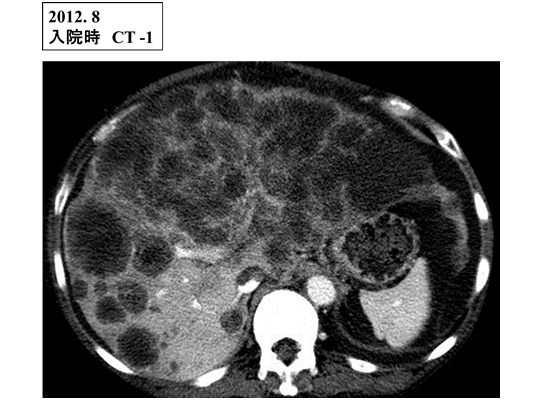
動注FOLFOX-Bが著効した末期的直腸癌肝転移の1例

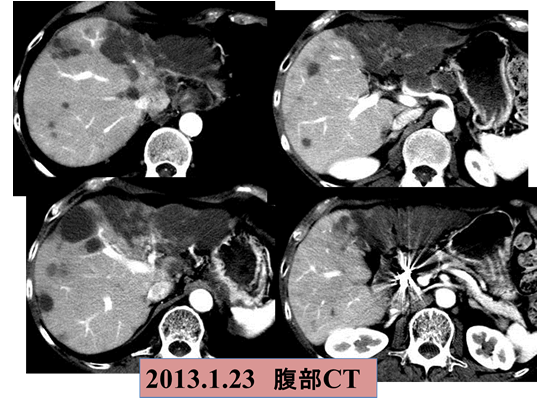
改めて肝動注の持つ局所制御力の強さを痛感しています。
肺転移に対する気管支動脈への動注治療
肺に転移したがんが切除不可能である場合、通常は全身性化学療法を行いますが、その効果は芳しいものではありません。当院では大腿部から留置した新しいタイプのシステム-iと形状付きマイクロカテーテルを用いて、気管支動脈への動注療法を行っています。
消化器内科(肝臓疾患)の詳しいご案内
肝臓の知識
肝臓Q&A
Q.肝臓とはどのような臓器ですか?
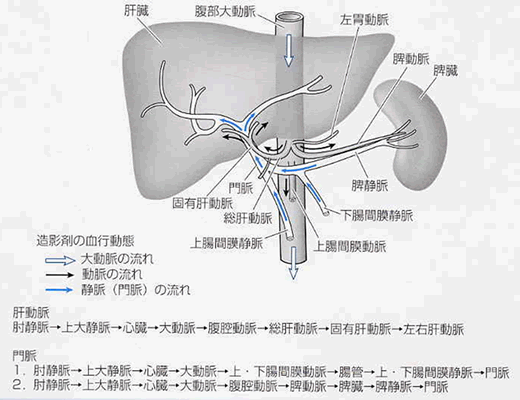
人体における巨大な生化学工場と呼ばれる臓器です。肝臓は大人の男性では1キロを超える巨大な臓器で、2500億~3000億個もの肝細胞から成り立っています。肝臓には門脈、肝動脈、肝静脈などが出入りしています。門脈は胃、腸、脾臓から肝臓に入ってくる静脈で、肝臓に流れ込んでいる血液の80パーセントは門脈から来ています。腸で吸収された栄養分のなかで脂肪以外のものは門脈から肝臓へ運ばれます。肝動脈は心臓から出ている大動脈から枝分かれした動脈で、肝臓が有害物質と戦うための酸素を供給しています。肝静脈は肝臓内の血液を集めて下大静脈に送る静脈です。肝臓では2000種以上の酵素がそれぞれの仕事を受け持ち、1万種以上の化学反応を行っています。これらのことから、肝臓が巨大な生化学工場と呼ばれる所以です。
Q.肝臓の機能にはどのようなものがありますか?
グルコースなどの糖代謝、アルブミンやプロトロンビンなどタンパクを作るタンパク代謝、コレステロールを合成する脂肪代謝機能があります。またビタミンA、D、Kなどの脂溶性ビタミンを貯えられます。そして、体内外の有害物質を解毒・排出する重要な働きがあります。
Q.肝臓が機能しなくなるとどうなりますか?
肝臓が機能しなくなった状態を肝不全といいます。肝不全になると、代謝や解毒など肝臓の役割を果たせなくなります。しかし、肝臓の実質臓器が20~30%残っていれば、生体に必要な要素は最低限まかなうことができます。ですので、少しぐらい切除しても充分に肝臓としての機能を果たすことができます。肝臓はそれだけ予備能が大きい組織と言えます。
Q.肝臓が機能しなくなる原因は何ですか?
肝臓には肝細胞や肝内胆管細胞などいろいろな細胞がありますが、その中で一番多いのが肝細胞です。この肝細胞が機能しなくなる原因で一番多いのがウイルスです。ウイルスが肝細胞に入り込むと生体はそれを異物と認識して、ただちにウイルスを除去しようとします。そのときに強烈な免疫反応が起こり、肝細胞が障害を受けるため正常に機能することができなくなります。ウイルス以外の原因としては血液障害やアルコール性肝障害などが原因になります。
Q.肝臓がんの原因は何ですか?
肝臓がんには、肝細胞がん、肝内胆管がん、転移性肝がんなどがあります。原発性肝細胞がんの原因として関係が深いのは肝炎ウイルス(B型・C型)と考えられています。が、たとえこれらのウイルスに感染しても、肝炎が慢性化しなければ肝がんにならなくて済みます。B型肝炎ウイルス(HBV)は、母子感染など、免疫不全の状態で感染すると慢性化しますが成人に感染しても慢性化しません。これに対してC型肝炎ウイルス(HCV)は、成人に感染しても50~80%が慢性化するといわれています。しかも、いつの間にか慢性肝炎や肝硬変に進展している場合が多いので注意が必要です。
Q.肝硬変と肝臓がんはどう違うのですか?
肝臓が破壊されて、それが再生しようとするときに線維化が起こり、肝機能を阻害する再生結節の集合体になりますが、その状態を「肝硬変」といいます。そして破壊された肝臓がもとの状態に戻ろうとするときに正常に戻れない細胞が肝臓がんです。肝臓がんの80パーセントは肝硬変を合併しています。ですので、肝硬変が長期化すれば高い確率で肝臓がんになります。
肝炎ウイルス
肝炎ウイルスに感染すると多くは「肝炎」という病気になります。その症状としては、全身倦怠(けんたい)感、食欲不振、尿の濃染(尿の色が紅茶のように濃くなる)、さらには黄疸などがあります。しかし、自覚的には何の兆候もなく、自然に治癒することもあります。また、肝炎ウイルスが身体に侵入しても、「肝炎」という病気にならず、健康な人体と共存共栄し、「ヒトは何らの身体的被害を受けず、肝炎ウイルスもヒトの身体から駆逐されず体内にとどまる」という状況もあります。このように、体内に肝炎ウイルスを持っていても健康な人のことを肝炎の「キャリア」といいます。肝炎ウイルスの感染経路としては次のようなものがあります。
1)妊娠・分娩による感染
妊娠・分娩を介して「肝炎ウイルスを持った母親」から子供へという感染経路があり、これを垂直感染といいます。この垂直感染は、主にB型肝炎に多く認められ、同一家族・家系に何人もの肝炎ウイルス感染者が存在することがあり、これを肝炎の「家族集積」といいます。現在では、B型、C型の肝炎ウイルスは検出可能で、妊娠中の母親は血液検査で肝炎ウイルスの有無が必ず調べられます。母親がB型ウイルスの保菌者と判明すると、垂直感染を防止するために、新生児には直ちにワクチン治療が行われ、B型肝炎の発病を防止する措置がとられています。
2)血液製剤の注射による感染
肝炎ウイルスを含んだ血液の輸血を受けると、輸血を受けた人の身体に肝炎ウイルスが侵入してしまいます。輸血が必要な場合は、病気・けがなどで身体の抵抗力が低下していることが多く、肝炎が高率に発症します。「輸血」にはいろいろな製剤がありますが、血液中の赤血球・血小板だけでなく、上澄み部分(血漿)などの「ある成分」だけを注射しても、肝炎ウイルスに感染する可能性があります。現在は、輸血に用いる血液はすべて厳重な品質管理が行われており、特にB型、C型についてはウイルスの有無を検査して、ウイルスの存在する血液は輸血には使わないという体制が確立しています。そのため、現在では輸血による肝炎は激減しています。ただし、B型にもC型にも検査で見つけられない場合がわずかながらあることも事実で、輸血による肝炎が完全にゼロになったわけではありません。輸血は生命を救う唯一の治療である場合も多々ありますので、輸血をしなければならないこともありますが、「どうしても必要な輸血」以外は慎むべきですし、この考え方は広く医師に定着してきています。
3)性行為による感染
性行為もウイルス感染の経路となる可能性があります。しかし、B型肝炎やC型肝炎の夫婦間感染率は低く、通常の性行為では感染する危険性は低いことが報告されています。ただし、B型肝炎にはHBe抗原が陽性の場合は感染力が強いので、専門医に相談することをお勧めします。
4)針刺し行為による感染
これは、医師・看護師などの医療従事者が、採血時や検査・処置・手術中などに肝炎ウイルスを持つ人の血液がついた針を誤って自分の皮膚に刺すなどの針刺し事故や、集団予防接種での針の再利用、入れ墨・針灸治療などに使った針の使いまわし、麻薬注射のまわし打ちなどで起こる感染のことです。事実、入れ墨を入れた方や、麻薬常習者では肝炎ウイルス感染が高率に認められています。しかし、集団予防接種での感染の問題は、現在では使い捨て注射針を用いていますので、心配ありません。
以上、肝炎ウイルスの感染ルートについて、現在わかっているものについて解説しました。しかし、1)~4)の感染ルートのどれにも思いあたるものがないという場合も多く、「このルートだ」と断定することは必ずしも容易ではありません。したがって、肝炎ウイルスの感染は個人の意識・知識によりある程度予防できますが、防止できない部分があることも事実です。肝炎ウイルスに感染してしまったら、即、肝がんになり、生命が脅かされるわけではありませんが、「肝がんの高危険群」と考えて対処すべきです。肝炎ウイルスに感染していることが判明するのは、
1)身体に変調をきたし、医師を受診してウイルス性肝炎と診断される
2)職場や居住地域の健康診断の血液検査で発見される
3)献血をした際に血液が輸血に適するか否かの検査で後日連絡を受ける
4)他の病気で医師を受診して手術や検査を受ける必要が生じた際の血液検査で判明する
などの場合があります。また、家族の一員が肝炎ウイルスに感染していることが判明すると、「家族集積」性を考慮して家族の他のメンバーの血液検査を勧めます。肝炎ウイルスに感染していることが判明したら、次には「キャリア」であるのか「肝炎」という病気になっているのかを調べる血液検査が必要です。
しかし、ともに肝がんにかかりやすい候補者と心得るべきで、「肝がんの高危険群」といいます。
高危険群の人に肝がんを発生させないような予防法についても、研究が進んでいます。現段階では、C型肝炎に対して期待されている治療は、インターフェロンフリーによる治療です。インターフェロンフリー治療により発がんのリスクを軽減できたとの報告も幾つかあります。また、最近では新薬の登場により従来より治療効果が高まっております。しかし、いずれもまだ十分な決め手となっていないのが現状ですので、高危険群者は肝がんにかかっても手遅れにならないうちに早期発見・治療することが必要です。感染以外の肝がんのリスク要因としては、大量飲酒と喫煙などがあります。ほかに、糖尿病患者でリスクが高いなどの研究報告があります。

































